temperatura y calor
Calor
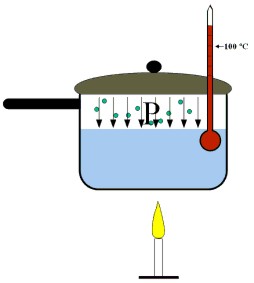 |
| Al aplicar calor, sube la temperatura. |
El calor es una cantidad de energía y es una expresión del movimiento de las moléculas que componen un cuerpo.
Cuando el calor entra en un cuerpo se produce calentamiento y cuando sale, enfriamiento. Incluso los objetos más fríos poseen algo de calor porque sus átomos se están moviendo. (Ver: Termodinámica, Tercera Ley)
Temperatura
La temperatura es la medida del calor de un cuerpo (y no la cantidad de calorque este contiene o puede rendir).
Diferencias entre calor y temperatura
Todos sabemos que cuando calentamos un objeto su temperatura aumenta. A menudo pensamos que calor y temperatura son lo mismo. Sin embargo, esto no es así. El calor y la temperatura están relacionadas entre sí, pero son conceptos diferentes.
Como ya dijimos, el calor es la energía total del movimiento molecular en un cuerpo, mientras que la temperatura es la medida de dicha energía. El calor depende de la velocidad de las partículas, de su número, de su tamaño y de su tipo. La temperatura no depende del tamaño, ni del número ni del tipo.
Por ejemplo, si hacemos hervir agua en dos recipientes de diferente tamaño, la temperatura alcanzada es la misma para los dos, 100° C, pero el que tiene más agua posee mayor cantidad de calor.
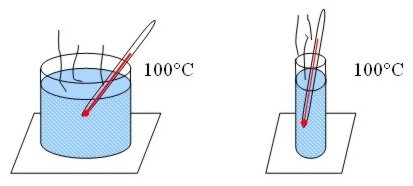 |
| Misma temperatura, distinta cantidad de calor. |
El calor es lo que hace que la temperatura aumente o disminuya. Si añadimos calor, la temperatura aumenta. Si quitamos calor, la temperatura disminuye.
La temperatura no es energía sino una medida de ella; sin embargo, el calor sí es energía.
Cambios de estado
En la naturaleza existen tres estados usuales de la materia: sólido, líquido y gaseoso. Al aplicarle calor a una sustancia, esta puede cambiar de un estado a otro. A estos procesos se les conoce como Cambios de estado. Los posibles cambios de estado son:
-de estado solidó a liquido, llamado fusión.
-de estado liquido a solidó, llamado solidificación.
-de estado liquido a gaseoso, llamado vaporización
-de estado gaseoso a liquido, llamado condensación
-de estado solidó a gaseoso, llamado sublimación progresiva.
-de estado gaseoso a sólido, llamado sublimación regresiva.
ejemplos de calor y temperatura
El calor se trasmite. Ejemplos:
-Calor que nos suministra el sol en una hora.
-Calor que expele un motor en marcha
-Calor que suministra una cocina en 30 minutos
Temperatura (velocidad promedio de las moléculas)...
Ejemplos:
-Temperatura media de mi cuerpo
- Temperatura de una piedra al sol.
- Temperatura de la cocina (disco) a los 3 minutos exactos de conectado.
-Calor que nos suministra el sol en una hora.
-Calor que expele un motor en marcha
-Calor que suministra una cocina en 30 minutos
Temperatura (velocidad promedio de las moléculas)...
Ejemplos:
-Temperatura media de mi cuerpo
- Temperatura de una piedra al sol.
- Temperatura de la cocina (disco) a los 3 minutos exactos de conectado.
MEDIDA DE LA TEMPERATURA
Se han inventado muchos instrumentos para medir la temperatura de forma precisa. Todo empezó con el establecimiento de una escala de temperaturas. Esta escala permite asignar un número a cada medida de la temperatura.
A principios del siglo XVIII, Gabriel Fahrenheit (1686-1736) creó la escala Fahrenheit. Fahrenheit asignó al punto de congelación del agua una temperatura de 32 grados y al punto de ebullición una de 212 grados. Su escala está anclada en estos dos puntos.
Unos años más tarde, en 1743, Anders Celsius (1701-1744) inventó la escala Celsius. Usando los mismos puntos de anclaje Celsius asignó al punto de congelación del agua una temperatura de 0 grados y al de ebullición una de 100 grados. La escala Celsius se conoce como el Sistema Universal. Es el que se usa en la mayoría de los paises y en todas las aplicaciones científicas.
Hay un límite a la temperatura mínima que un objeto puede tener. La escala Kelvin está diseñada de forma que este límite es la temperatura 0. La relación entre las diferentes escalas de temperatura es la siguiente:
ejercicios
Problema 1.
Calcular la cantidad de calor necesario para elevar la temperatura a 10 Kg. De cobre de 25 ºC a
125 ºC
m = 10 Kg. = 10000 gr.
T1 = 25 ºC
T2 = 125 ºC
Ce = 0.09 Cal/gr.ºC
Q = m * Ce * (T2 – T1)
Q = 10000 gr. * 0.09 Cal/gr.ºC * (125 ºC - 25 ºC)
Q = 900 * 100 = 90000 calorías
Q = 90.000 calorías
Problema 2. Se tiene un tanque que contiene 20.000 gr. de agua a 10 ºC. Cuantas Kilocalorías absorbe
cuando se calienta hasta 40 ºC.
Agua:
m1 = 20.000 gr.
T1 = 10 ºC
Tf = 40 ºC
Ce = 1 Cal/gr.ºC
Q1 = m1 * Ce * (Tf – T1)
Q1 = 20.000 gr. * 1 Cal/gr.ºC * (40 ºC - 10 ºC)
Q1 = 20.000 * (30) calorías
Q1 = 600.000 calorías = 600 Kcalorías
http://www.monografias.com/trabajos-pdf4/problemas-resueltos-equilibrio-termico/problemas-resueltos-equilibrio-termico.pdf
http://www.monografias.com/trabajos-pdf4/problemas-resueltos-equilibrio-termico/problemas-resueltos-equilibrio-termico.pdf
DILATACIÓN TÉRMICA
De una forma general, cuando aumentamos la temperatura de un cuerpo (sólido o líquido), aumentamos la agitación de las partículas que forman ese cuerpo. Esto causa un alejamiento entre las partículas, resultando en un aumento en las dimensiones del cuerpo (dilatación térmica). Por otra parte, una disminución en la temperatura de un cuerpo, acarrea una reducción en sus dimensiones (construcción térmica)
En la construcción civil, por ejemplo, para prevenir posibles trincas y rupturas por causa de dilatación térmica de los materiales, se utilizan “folgas” llamadas como juntas de dilatación.
ejemplos
Objeto
|
¿Por qué?
|
Vías de un tren.
|
Su dilatación se hace notable en verano por el clima.
|
Las ruedas de los coches.
|
Si la temperatura aumenta, el aire que contienen las ruedas gana presión y se dilata.
|
Las puertas de una casa.
|
Dependiendo de la temperatura se dilatan un poco y se es notable al querer abrir o cerrar esta misma.
|
Asfalto de la carreteras.
|
Cuando hace calor este aumenta su tamaño, es por eso que el pavimento esta hecho por bloques separador por una partitura que permite que se ensanche y no se quebré.
|
El mercurio contenido en un termómetro.
|
Se dilata con el calor y es por eso que nos indica la temperatura y al estar expuesto a un lugar no muy caliente se contrae.
|
DILATACIÓN LINEAL
Más allá que la dilatación de un sólido suceda en todas las dimensiones, puede predominar la dilatación de apenas una de sus dimensiones sobre las demás. O aún, podemos estar interesados en una única dimensión del sólido. En este caso, tenemos la dilatación lineal (DL)
ejemplo
dilatación en hilos, cabos y barras.

ejercicio
Qué cantidad de calor necesita absorber un trozo de cobre cuya masa es 25g si se encuentra a una temperatura de 8ºC y se desea que alcance una temperatura final de 20ºC?
Q = x
m = 25g
ce = 0,093cal
ºC g
tº inicial = 8ºC
tº final = 20ºC tº = 20ºC - 8ºC = 12ºC
Q = 25g • 12ºC • 0,093cal
Q = 27,9 calorías
Q = x
m = 25g
ce = 0,093cal
ºC g
tº inicial = 8ºC
tº final = 20ºC tº = 20ºC - 8ºC = 12ºC
Q = 25g • 12ºC • 0,093cal
Q = 27,9 calorías
DILATACIÓN SUPERFICIAL
La dilatación superficial corresponde a la variación del área de una placa, cuando sometida a una variación de temperatura. Las figuras a continuación, representan una placa rectangular a temperatura To a temperatura T >To.
ejemplo
Dilatación Superficial
Es aquella en la que predomina la variación en dos (2) dimensiones de un cuerpo, es decir: el largo y el ancho.

ejercicio
A una temperatura de 17°C una ventana de vidrio tiene un área de 1.6m2. ¿Cuál será su área final al aumentar su temperatura a 32°C?
(Y) Vidrio=14.6x10-6 °C-1
Ao=1.6m2
To=17°C
Tf=32°C
Af=?
Af=1.6m2 [1+14.6x10-6°C-1 (32°C-17°C)
1.6003504m2
DILATACION CUBICA O VOLUMETRICA
En este tipo de dilatación, vamos a considerar la variación del volumen, esto es, la dilatación en las tres dimensiones del sólido (longitud ancho y altura). Veamos el ejemplo del cuadro debajo:
ejemplo
Dilatación Volumétrica
Es aquella en la predomina la variación en tres (3) dimensiones de un cuerpo, es decir: el largo, el ancho y el alto.

ejercicio
Un cubo de cobre mide 40 cm3 por lado a 20°c ¿cual es el volumen del cubo en m3 cuando la temperatura llega a 150°c?
V=Vo+Vo*α*(150ºC-20ºC)
α=5*10-5*1/ºC
V=40cm3+40cm3*5*10-5(130)
V=40.26cm^3
V=4.026*10^-5m^3
α=5*10-5*1/ºC
V=40cm3+40cm3*5*10-5(130)
V=40.26cm^3
V=4.026*10^-5m^3
DILATACIÓN DE LÍQUIDOS
Los sólidos tienen forma propia y volumen definido, pero los líquidos tienen solamente volumen definido. Así, el estudio de la dilatación térmica de los líquidos es realizado solamente en relación a la dilatación volumétrica. Esta obedece a una ley idéntica a la dilatación volumétrica de un sólido o sea, la dilatación volumétrica de un líquido podrá ser calculada por las mismas fórmulas de la dilatación volumétrica de los sólidos.
Veamos en esta tabla, el coeficiente de dilatación de algunos líquidos, medidos en
Veja na tabela abaixo, o coeficiente de dilatação de alguns líquidos, medido em oC -1
| Agua 1,3 . 10-4 |
| Mercurio 1,8 . 10-4 |
| Glicerina 4,9 . 10-4 |
| Benceno 10,6 . 10-4 |
| Alcohol 11,2 . 10-4 |
| Acetona 14,9 . 10-4 |
| Petróleo 10 . 10-4 |
ejemplo
1- Dilatación de líquidos "volumétrica": un frasco lleno de mercurio (al ras), al ser calentado desbordaría y se derramaría.
http://orozco2608.blogspot.com/2012/04/dilatacion-termica-objetos-y-ejemplos.html
http://fisica.laguia2000.com/conceptos-basicos/dilatacion-termica
http://www.fisicanet.com.ar/fisica/termoestatica/ap05_dilatacion.php
CALORIMETRIA
La Calorimetría es la parte de la física que se encarga de medir la cantidad de calor generada en ciertos procesos físicos o químicos.
El aparato que se encarga de medir esas cantidades es el calorímetro. Consta de un termómetro que esta en contacto con el medio que esta midiendo. En el cual se eencuentran las sustancias que dan y reciben calor. Las paredes deben estar lo más aisladas posible ya que hay que evitar al máximo el intercambio de calor con el exterior. De lo contrario las mediciones serían totalmente erróneas.
También hay una varilla como agitador para mezclar bien antes de comenzar a medir. Básicamente hay dos tipos de calorímetros. Los que trabajan a volúmen constante y los de presión constante.
El aparato que se encarga de medir esas cantidades es el calorímetro. Consta de un termómetro que esta en contacto con el medio que esta midiendo. En el cual se eencuentran las sustancias que dan y reciben calor. Las paredes deben estar lo más aisladas posible ya que hay que evitar al máximo el intercambio de calor con el exterior. De lo contrario las mediciones serían totalmente erróneas.
También hay una varilla como agitador para mezclar bien antes de comenzar a medir. Básicamente hay dos tipos de calorímetros. Los que trabajan a volúmen constante y los de presión constante.
La cantidad de calor que recibe o transmite un cuerpo esta determinada por la siguiente fórmula:
Q = m x Ce x (Tf – Ti)
Donde Q es el calor, m es la masa del cuerpo, Ce es el calor específico del cuerpo, que esta determinada por el material que lo compone. Y la vraiación de temperatura se representa por la diferencia entre Tf y Ti (temperatura final e inicial).
Cuando un cuerpo transmite el calor hay otro que lo recibe. Este es el principio del calorímetro. Ya que el termómetro determinara la temperatura final o también llamada de equilibrio. El líquido más usado es el agua que actúa como receptor de las calorías que transmite el cuerpo. El calor específico del agua es de 1cal /grs °C. Cuando el agua hierve o se congela este valor cambia a otros.
ejemplo
si introducimos un trozo de cobre de 60 gramos a 100°C en 260 ml de agua a 18°C y tenemos que determinar la temperatura final del equilibrio podemos calcularla de la siguiente manera:
El calor que cede del cobre será igual al calor que recibe el agua. Por lo tanto:
- Q Cu = + Q H2O
El signo menos se le coloca al que desprende calor y el signo más al que absorve.
- masa Cu x Cecu x (Tf – 100°C) = masa H2O x CeH2O x (Tf – 18°C)
- 60
grs x (0,093 cal/°c.
gr) x (Tf – 100°C) = 260
grs x (1 cal/°c.
gr) x (Tf – 18°C)
Solo queda despejar la Tf.
-5.58 cal/°C x (Tf – 100°C) = 260 cal/°C x (Tf – 18°C)
ejercicios
Aplicamos la propiedad distributiva:
-5.58 cal/°C Tf + 558 cal = 260 cal/°C Tf – 4680 cal
558 cal + 4680 cal = 260 cal/°C Tf + 5.58 cal/°C Tf
5238 cal = 265.58 cal/°C Tf
5238
cal / 265.18
cal/°C = Tf
19.72°C = Tf
En otros problemas a veces nos piden averiguar el calor específico de un cierto material. Por ejemplo:
Se introducen 20 gramos de aluminio a 90°C dentro de un calorímetro donde hay 106 grs de agua a 38°C. La temperatura final del equilibrio es de 40°C. Se desea saber el calor específico del aluminio.
El calor entragado por el cuerpo mas caliente (Aluminio) es igual al calor recibido por el mas frio (agua).
- Q aluminio = + Q agua
- masa Al x CeAl x (Tf – Ti) = masa agua x Ce agua x (Tf – Ti)
- 20 grs x CeAl x (40°C – 90°C) = 106
grs x 1 cal/
grs°C x (40°C – 38°C)
- 20 grs x (-50°C) x CeAl = 106 cal/
°C x (2
°C)
1000 grs °C x CeAl = 212 cal
Ce Al = 212 cal / 1000 grs °C
CeAl = 0,212 cal/grs°C
En otros el calorímetro participa. Por ejemplo:
Se introducen 30 grs de Aluminio a 120°C en un calorímetro de cobre de 360 grs donde hay 200 grs de agua a 20°C. Calcular la temperatura final del equilibrio.
El calor que pierde el aluminio es igual al que gana el calorímetro y el agua.
- QAl = + Q agua + Q calorímetro
- 30 grs x 0,212 cal/gr°C x (Tf – 120°C) = 200grs x 1 cal/gr°C x (Tf – 20°C) + 360 grs x 0,093 cal/gr°C x (Tf – 20°C)
6,36 cal/°C Tf + 763,2 cal = 200 cal/°C Tf - 4000 cal + 33,48 cal/°C Tf - 669,6 cal
6,36 cal/°C Tf - 200 cal/°C Tf - 33,48 cal/°C Tf = – 4000 cal – 669,6 cal – 763,2 cal
-227,12 cal/°C Tf = – 5432,8 cal
Tf = – 5432,8 cal / – 227,12 cal/°C
Tf = + 23,92 °C
http://www.quimicayalgomas.com/fisica/que-es-la-calorimetria/
UNIDAD DE LA CANTIDAD DE CALOR
El calor es posible definirlo como energía transferida entre dos cuerpos o sistemas, se puede asociar al movimiento de los átomos, moléculas y otras partículas que forman la materia. El calor puede ser generado por reacciones químicas (como en la combustión), reacciones nucleares (como en la fusión nuclear de los átomos de hidrógeno que tienen lugar en el interior del Sol), disipación electromagnética (como en los hornos de microondas) o por disipación mecánica (fricción). Su concepto está ligado al Principio Cero de la Termodinámica, según el cual dos cuerpos en contacto intercambian energía hasta que su temperatura se equilibre.
La cantidad de energía térmica intercambiada se mide en calorías, que es la cantidad de energía que hay que suministrar a un gramo de agua para elevar su temperatura de 14,5 a 15,5 grados celsius. El múltiplo más utilizado es la kilocaloría (kcal):
1 kcal = 1000 cal
De aquí se puede deducir el concepto calor específico de una sustancia, que se define como la energía necesaria para elevar la temperatura de un gramo de dicha sustancia un grado celsio, o bien el concepto capacidad calorífica, análogo al anterior pero para una masa de un mol de sustancia (en este caso es necesario conocer la estructura química de la misma).
Joule, tras múltiples experimentaciones en las que el movimiento de unas palas, impulsadas.por un juego de pesas, se movían en el interior de un recipiente con agua, estableció el equivalente mecánico del calor, determinando el incremento de temperatura que se producía en el fluido como consecuencia de los rozamientos producidos por la agitación de las palas:
1 cal = 4.184 J
El joule (J) es la unidad de energía en el Sistema Internacional de Unidades, (S.I.).
El BTU, (o unidad térmica británica) es una medida para el calor muy usada en Estados Unidos y en muchos otros países de América. Se define como la cantidad de calor que se debe agregar a una libra de agua para aumentar su temperatura en un grado Fahrenheit, y equivale a 252 calorías.
La cantidad de energía térmica intercambiada se mide en calorías, que es la cantidad de energía que hay que suministrar a un gramo de agua para elevar su temperatura de 14,5 a 15,5 grados celsius. El múltiplo más utilizado es la kilocaloría (kcal):
1 kcal = 1000 cal
De aquí se puede deducir el concepto calor específico de una sustancia, que se define como la energía necesaria para elevar la temperatura de un gramo de dicha sustancia un grado celsio, o bien el concepto capacidad calorífica, análogo al anterior pero para una masa de un mol de sustancia (en este caso es necesario conocer la estructura química de la misma).
Joule, tras múltiples experimentaciones en las que el movimiento de unas palas, impulsadas.por un juego de pesas, se movían en el interior de un recipiente con agua, estableció el equivalente mecánico del calor, determinando el incremento de temperatura que se producía en el fluido como consecuencia de los rozamientos producidos por la agitación de las palas:
1 cal = 4.184 J
El joule (J) es la unidad de energía en el Sistema Internacional de Unidades, (S.I.).
El BTU, (o unidad térmica británica) es una medida para el calor muy usada en Estados Unidos y en muchos otros países de América. Se define como la cantidad de calor que se debe agregar a una libra de agua para aumentar su temperatura en un grado Fahrenheit, y equivale a 252 calorías.
ejemplos
el calor especifico del agua 1 cal y el de el alcohol es 0,6cal esto significa que la cantidad de calor de absorbe un gr de agua es mayor que la cantidad de calor que absorbe un gramo de alcohol para elevar su temperatura a 1c
ejercicio
¿Qué cantidad de calor necesita absorber un trozo de cobre cuya masa es 25g si se encuentra a una temperatura de 8ºC y se desea que alcance una temperatura final de 20ºC?
Datos:
Q = x
m = 25g
ce = 0,093cal
ºC g
tº inicial = 8ºC
tº final = 20ºC tº = 20ºC - 8ºC = 12ºC
Aplicando la fórmula: Q = c tº m
Reemplazando: Q = 25g · 12ºC · 0,093cal
ºC g
Q = 27,9 calorías
¿Cuánto calor necesitan 250cc de agua para llegar a una temperatu-ra de 100ºC, es decir, para convertirse en vapor, si se encuentra a una temperatura de 20ºC?
Datos:
Q = x
m = 255cc = 255g
ce = 1cal
ºC g
tº inicial = 20ºC
tº final = 100ºC tº = 100ºC - 20ºC = 80ºC
Aplicando la fórmula: Q = c tº m
Reemplazando: Q = 255g · 80ºC · 1cal
ºC g
Q = 20.000 calorías
Datos:
Q = x
m = 25g
ce = 0,093cal
ºC g
tº inicial = 8ºC
tº final = 20ºC tº = 20ºC - 8ºC = 12ºC
Aplicando la fórmula: Q = c tº m
Reemplazando: Q = 25g · 12ºC · 0,093cal
ºC g
Q = 27,9 calorías
¿Cuánto calor necesitan 250cc de agua para llegar a una temperatu-ra de 100ºC, es decir, para convertirse en vapor, si se encuentra a una temperatura de 20ºC?
Datos:
Q = x
m = 255cc = 255g
ce = 1cal
ºC g
tº inicial = 20ºC
tº final = 100ºC tº = 100ºC - 20ºC = 80ºC
Aplicando la fórmula: Q = c tº m
Reemplazando: Q = 255g · 80ºC · 1cal
ºC g
Q = 20.000 calorías
http://es.slideshare.net/ernestoyanezrivera/cantidad-de-calor-3
PRINCIPIOS DE LA FUSIÓN
Fusión es un concepto de la Física que designa el proceso que experimenta una sustancia cuando, al haber alcanzado su punto de fusión, pasa del estado sólido al líquido, por acción de un aumento de temperatura y a una presión determinada.
Punto de fusión
Como punto de fusión conocemos la temperatura en la cual se realiza una fusión, considerando la presión. Es constante e invariable cuando una sustancia es sometida a una presión normal. Del mismo modo, su temperatura será constante durante el tiempo de la fusión, es decir, una vez alcanzado el punto de fusión no aumentará. El punto de fusión varía de sustancia en sustancia, y es por ello que representa una propiedad característica para cada elemento. En el agua, por ejemplo, el punto de fusión ocurre a 0° C a la presión de una atmósfera
Fusión nuclear
En Física, la fusión nuclear se refiere a la reacción nuclear exotérmica producida por la unión de dos núcleos atómicos ligeros, dando paso a un núcleo más pesado y a un importante desprendimiento de energía. La energía solar, por ejemplo, se origina por la fusión nuclear del hidrógeno que ocurre en el Sol, lo mismo ocurre en el resto de las estrellas del Universo. La fusión nucleares fundamental en la reacción de bombas termonucleares o bombas de hidrógeno.

Fusión nuclear y fisión nuclear
Como fisión nuclear se designa la reacción nuclear que ocurre cuando el núcleo de un átomo pesado se divide en dos o más núcleos que, en consecuencia, serán más ligeros. En este sentido, la fisión nuclear será el proceso inverso a la fusión nuclear, que consiste en la unión de núcleos de átomos ligeros para formar uno más pesado. Ambos, sin embargo, son procesos exotérmicos, pues liberan importante cantidad de energía.
Fusión en Química
Dentro del campo de la Química, la fusión se aplica para desarrollar distintas tareas, como la separación de una sustancia fusible de otra infusible, procedimiento que se denomina separación por fusión o licuación; para unir dos o más sustancias en una masa homogénea, aprovechada para la aleación de los metales; así como para la unión química de sustancias diferentes, con la finalidad de crear un nuevo compuesto químico

ejemplos
- El hielo a temperatura ambiente se convierte en agua.
- Si ponemos al fuego unas velas, cambiara a parafina líquida.
- Un metal a altas temperaturas llegara a hacerse liquido.
- el vidrio también a altas temperaturas se vuelve liquido.
- El platico se derrite con el calor o mas bien el fuego.
ejercicio
Qué cantidad e hidrogeno será necesario para obtener por fusión nuclear 105 KWh. de energía? (pg. 40 2)
105 KWh = 3,6 106 J /KWh
* 105 KWh =
3,6 1011 J
principio de solidificacion
La solidificación es un proceso que se logra de modo inverso a la fusión, y que se produce por el enfriamiento de los líquidos. El punto de fusión que es aquella temperatura por la cual el sólido pasa al estado líquido, es el mismo punto en que se produce el proceso inverso de solidificación. En el agua ocurre a 0º C.
Se trata de un proceso físico que generalmente implica una disminución del volumen del cuerpo, salvo en el agua, que aumenta su volumen al solidificarse.
Al sustraerse calor al líquido éste irá disminuyendo su temperatura, las partículas que lo componen tendrán cada vez menos movimiento, hasta que se ordenan, tomando una posición en la estructura cristalina. Ese es el momento en que se opera la solidificación, y el líquido perderá su capacidad de fluir.
También puede ocurrir la solidificación de metales, dentro de la fabricación de productos con esos materiales, para darles forma. Primero el metal se calienta para pasarlo al estado líquido, y luego se le retira energía para que solidifique dentro de moldes, y vuelva a su estado sólido original. La temperatura va a ir disminuyendo en forma uniforme y continua hasta que comienza la solidificación.
Los metales puros, que requieren una temperatura constante para su solidificación, pasan por varias etapas antes de solidificarse. La primera es la nucleación, donde solo se solidifican ciertos puntos específicos, formándose granos finos. Cuando se amplía esta solidificación formándose dendritas o cristales, estamos en la etapa de cristalización. Estas dendritas se van ampliando hasta que todo el material se solidifica, formando los límites de grano en las regiones de encuentro.
En las aleaciones, la solidificación no ocurre a temperaturas constantes, sino en intervalos de temperaturas.
ejemplos
La solidificación es un proceso físico que consiste en el cambio de estado de la materia de líquido a sólido.En general, los compuestos disminuyen de volumen al solidificarse, aunque no sucede en todos los casos; en el caso del agua aumenta.
Toda sustancia pura pasa a estado sólido a una determinada temperatura llamada punto de solidificación.
Durante la solidificación la temperatura permanece constante.
1- Agua => hielo
2- vidrio liquido => vidrio solido
3- barro => ladrillo
4- cera liquida => vela
5- oro => anillos, cadenas etc.
ejercicios
A Partir del diagrama de equilibrio de fases de la aleación de Sn y Pb, totalmente solubles en estado líquido y parcialmente insolubles en estado sólido, con un eutéctico.
a) Determina el número de fases, su composición y la cantidad relativa, en %, de cada una de ellas, para una aleación con una concentración Co=30% de Pb a una temperatura de 250ºC.
b) Repite el apartado anterior para una aleación Co=60% de Sn a 350ºC.
 |
A Partir del diagrama de equilibrio de fases de la aleación de dos metales A y B, totalmente solubles en estado líquido y parcialmente insolubles en estado sólido, con un eutéctico.
a) Indicar los puntos, líneas y zonas significativas del diagrama.
Analizar el número de fases, de constituyentes, su concentración y las cantidades relativas de éstos para los siguientes puntos:
b) En el eutéctico, a 200ºC para Co=40% de A.
c) Para 400ºC y Co=80% de A.
d) Para Co=80% de A.y a una temperatura inmediatamente por encima del eutéctico 200ºC+ΔT.
e) Para Co=80% de A.y a una temperatura inmediatamente por debajo del eutéctico 200ºC-ΔT.
f) Para 100ºC y Co=80% de A.
 |
A partir del diagrama de equilibrio de fases de la aleación de dos metales A y B, totalmente solubles en estado líquido e insolubles en estados sólido y con eutéctico.
a) Indicar: zonas, puntos y líneas significativas del diagrama.
b) Para una aleación de concentración Co=40% de A, que se ha calentado hasta la zona monofásica líquido. Analizar todo lo que va ocurriendo durante el proceso de enfriamiento, suficientemente lento, hasta alcanzar la temperatura ambiente.
c) Repetir el apartado anterior para aleación de concentración Co= 80% de A y Co= 20% de A.
d) Para una aleación de Co=70% de A que se encuentra a 600ºC, determinar el número de fases y las cantidades estas que están presentes.
e) Repetir el apartado anterior si la aleación se encuentra a 300ºC.
 |
http://e-ducativa.catedu.es/44700165/aula/archivos/repositorio/4750/4910/html/7_problemas_resueltos.html
Lee todo en: Concepto de solidificación - Definición en DeConceptos.com http://deconceptos.com/ciencias-naturales/solidificacion#ixzz3U1P274zz
vaporacion
el latín evaporatio, la evaporación es la acción y efecto de evaporar o evaporarse. Este verbo, por su parte, hace referencia a la transformación de un líquido en vapor.
Durante el proceso físico denominado evaporación, una sustancia líquida pasa lenta y gradualmente a un estado gaseoso, una vez que haya adquirido la energía necesaria para aumentar su superficie. Es importante no confundir este término con ebullición, ya que la evaporación no requiere de una temperatura en particular; más aún, cuanto mayor sea ésta, antes tendrá lugar.
Cabe mencionar que se trata de un fenómeno absolutamente necesario para el ciclo de la vida, dado que el agua en estado gaseoso se condensa y se convierte en nubes, las cuales recobran su forma líquida durante la lluvia, que mantiene fértiles nuestros suelos. Asimismo, este regreso del agua a la tierra puede darse a través de las nevadas, de rocío o de niebla.
Sobre la superficie de una sustancia líquida, a menos que haya alguna obstrucción, una porción de sus moléculas se encuentra en estado gaseoso; cuando ésta se equilibra se establece la presión de la fase gaseosa saturante, que no está directamente relacionada con el volumen, sino con la temperatura y el tipo de líquido. Si la cuantía de gas es menor a dicha presión, entonces tiene lugar la evaporación, ya que un porcentaje de las moléculas cambia de estado; por otro lado, si la presión es igual a la de la atmósfera se da la ebullición.
Cuando muy pocas moléculas se encuentran cercanas a la superficie y realizando un movimiento dirigido correctamente para lograr salir del líquido en algún momento, el porcentaje de evaporación es limitado. Más aún, dado que las que consiguen escapar son las que poseen más energía que las restantes, la sustancia sufre una reducción considerable de su temperatura (esto se denomina enfriamiento evaporativo, y tiene lugar durante el fenómeno de la sudoración).
ejemplos
cuándo se forman nubes, el agua se ha evaporado del mar.
- cuándo estás cocinando y la tapa de la cazuela está toda húmeda, es porque ha habído una evaporación del líquido del interior de la cazuela.
- si dejas un cubito de hielo al sol, dentro de un rato se va a derretir, y parte de su líquido se habrá evaporado y estará en el aire.
ejercicio
El cálculo del evaporador lleva a establecer fundamentalmente los balances de materia y de calor para determinar el área de transferencia de calor y con base a las consideraciones expuestas en lo numerales anteriores, entrar a seleccionar el equipo más adecuado y proceder a distribuir el área en el sistema operacional (tubos, superficies cilíndricas, superficies planas, etc.)
Una solución acuosa al 1% en peso es alimentada a un evaporador a 700C y va a ser concentrada al 10%, empleando como medio de calefacción vapor a 30 psi. Para una alimentación de 500 kilos por hora, determinar:
- Cantidad de agua evaporada.
- Cantidad de vapor consumido si la entalpía del producto es 180 kcal / kg.
- El área de transferencia de calor, si el coeficiente total U es de 580 kcal m2hr0C.
Solución: Balances de materiales nos permiten encontrar la cantidad de agua evaporada.
Llamando F, P y V a la alimentación, producto y agua evaporada respectivamente, el balance total es:
F = P+V ====è 500 k/hr = P+V
El balance sobre los sólidos es:
0,01F = 0,10P ===è P = 0.1F = 0,1 x 500 = 50 kg/hr
La cantidad de agua evaporada V + F - P
V = 500 - 50 = 450 kg/hr
- Un balance de energía determina la cantidad de vapor consumido, S
FHf + SHs = PHp + SHc + VHv
Para la resolución de esta ecuación establecemos que: la solución acuosa siendo 99% de agua, tiene propiedades, como la entalpía similar a la del agua; la evaporación ocurre a presión atmosférica y el vapor al ceder calor se condensa, y el agua condensada sale a esta temperatura de condensación. Bajo estas condiciones y de tablas.
Hs= 651,7 kcal/kg (T= 137 0C)
Hc= 136 kcal/kg (T= 137 0C)
Hf= 70 Kcal/kg
Hv= 540 kcal/kg
Reemplazando en la ecuación y con base en una hora
500 x 70 + S x 651,7 = 50 x 180 + S x 136 + 450 x 540
515,7 S = 9.000 + 243.000 - 35.000 = 217.000
S = 421.kg.
- La cantidad total de calor transferido es de 217.000 kcal/hr que es igual al calor cedido por el vapor al condensarse. El área de transferencia será:
A = Q / U T = 217.000 / 580 (137 - 100) = 10,11 m2
En la presentación y desarrollo del anterior ejemplo, se presentan algunos interrogantes. ¿ El punto de ebullición de la solución es de 700C? ¿O es mayor o menor? ¿La temperatura de salida de la solución es la misma de entrada? ¿El vapor empleado como elemento de calefacción se condensa a los 30 psi y luego se enfría a 1000C?
Normalmente las soluciones acuosas tienen para la misma temperatura del agua pura presiones de vapor menores; por consiguiente, su temperatura de ebullición es mayor que la del agua a la misma presión.
La diferencia de temperatura entre el punto de ebullición de la solución y el punto de ebullición del agua, a la misma presión, es la elevación del punto de ebullición de la solución.
Si bien para el ejemplo anterior los interrogantes expuestos no afectan el balance total de energía, la solución por tener un punto de ebullición superior al del agua está entrando muy fría al evaporador, igualmente la solución sale a temperatura de ebullición y el vapor de calefacción puede enfriarse a menos de 100 0C ya que se presenta un T en la solución inicial de 300C.
La elevación del punto de ebullición depende básicamente del soluto y de la concentración del mismo. Es pequeña para soluciones diluidas o de coloides orgánicos, pero puede ser muy alta para soluciones de sales inorgánicas de alta concentración. Para soluciones diluidas puede emplearse la ecuación de Clausius Clapeyron.
T = (RT2 / H Vap) X = kb m
donde: T = Es la elevación del punto de ebullición
R = Constante de los gases
To = Temperatura de ebullición del solvente a presión P.
H vap = Entalpía de vaporización a presión P.
X = Fracción molar del soluto.
kb = Constante molar del punto de ebullición del solvente.
m = Número de moles del soluto o fracción molar
H vap = Entalpía de vaporización a presión P.
X = Fracción molar del soluto.
kb = Constante molar del punto de ebullición del solvente.
m = Número de moles del soluto o fracción molar
Lee todo en: Definición de evaporación - Qué es, Significado y Concepto http://definicion.de/evaporacion/#ixzz3U1Uc4Er0
http://datateca.unad.edu.co/contenidos/211612/contLinea_eXe_/leccin_34_clculos_en_evaporadores.html
ebullicion
uele definirse al punto de ebullición como el instante en el cual se produce el cambio de estado de una materia que pasa de líquido a gaseoso. El concepto, en concreto, refiere a la temperatura que provoca que la presión de vapor de un líquido iguale a la presión de vapor del medio en cuestión.
En otras palabras, el punto de ebullición hace mención a la temperatura en la cual un líquido hierve. Dicha temperatura está vinculada a las propiedades específicas del líquido, y no a su cantidad. Es importante resaltar que, una vez que el líquido entró en ebullición (y está hirviendo), la temperatura no sufre ninguna variación.

La temperatura de la materia está vinculada a la energía cinética de sus moléculas. Lo habitual es que unas pocas moléculas puedan quebrar la tensión superficial: sin embargo, una vez alcanzada la temperatura del punto de ebullición, se incrementa la entropía y las partículas se desordenan.
Tomemos el caso del agua. El punto de ebullición del H2O es 100 grados centígrados. Esto quiere decir que podemos poner agua a temperatura de ambiente (20 grados, por ejemplo) en un jarro y llevar el recipiente al fuego. El agua, en este momento, estará en estado líquido.
ejemplos
Sustancia Punto de fusión Punto de ebulliciónNitrógeno -210 -196
Oxígeno -218 -183
Agua 0 100
Alcohol -114,4 87,4
Mercurio -38,9 357Glicerina -40 290
Aluminio 660 2060
Cobre 1083 2595
Hierro 1539 2740
Oro 1064 2856
Oxígeno -218 -183
Agua 0 100
Alcohol -114,4 87,4
Mercurio -38,9 357Glicerina -40 290
Aluminio 660 2060
Cobre 1083 2595
Hierro 1539 2740
Oro 1064 2856
ejercicios
Ejercicio 1:
Calcular el punto de ebullición de una soluciòn de 100 gramos de anticongelante etilenglicol en 900 gramos de agua (Keb: 0,52 Kg. °C/mol)
El resultado debe dar: -3,33 °C
Ejercicio 2:
Determine la constante ebulloscòpica de un solvente, si al disolver 100 gramos de urea (masa molar 60 g/mol) en 250 gramos de este solvente, éste incrementa su temperatura de ebulliciòn en 2,1 °C
El resultado debe ser: 0,315 Kg. °C/mol
Ejercicio 3:
Calcule la masa molar de un no electrolito si el agua se congela a -0,50 °C cuando en 20 gramos de ella se disuelven 12 gramos de soluto.
El resultado debe dar: 2232 g/mol
Calcular el punto de ebullición de una soluciòn de 100 gramos de anticongelante etilenglicol en 900 gramos de agua (Keb: 0,52 Kg. °C/mol)
El resultado debe dar: -3,33 °C
Ejercicio 2:
Determine la constante ebulloscòpica de un solvente, si al disolver 100 gramos de urea (masa molar 60 g/mol) en 250 gramos de este solvente, éste incrementa su temperatura de ebulliciòn en 2,1 °C
El resultado debe ser: 0,315 Kg. °C/mol
Ejercicio 3:
Calcule la masa molar de un no electrolito si el agua se congela a -0,50 °C cuando en 20 gramos de ella se disuelven 12 gramos de soluto.
El resultado debe dar: 2232 g/mol
http://www.acienciasgalilei.com/public/forobb/viewtopic.php?f=54&t=8133
propagacion de calor
uando nos preguntamos acerca de la propagación del calor, en realidad lo que queremos saber es cómo se propaga la energía desde los cuerpos calientes a los fríos. Decir “propagación del calor” es una forma de hablar: lo que en realidad se propaga es la energía, que es lo que poseen los cuerpos.
Existen tres maneras en las que la energía térmica se propaga de unos cuerpos a
otros: conducción, convección y radiación.
Existen tres maneras en las que la energía térmica se propaga de unos cuerpos a
otros: conducción, convección y radiación.

ejemplos
1.-Conducción
Esta forma de propagación se da en los sólidos, cuando se aplica calor a un objeto sólido, la zona donde absorbe calor se calienta y sus partículas adquieren mayor movilidad que el resto del cuerpo y cada partícula transmite el calor a las partículas vecinas, con el cual el calor acaba por propagarse por todo el objeto.
Ejemplos:
- Utensilios metálicos para cocinar, como por ejemplo una olla de acero. Esta recibe el calor en la base y luego se propaga por toda la olla. Es por ello que las asas tienen que ser de un material aislante como madera o plástico, para no sufrir quemaduras.
- Tenemos un vaso de leche que está muy caliente. En su interior se introduce una cuchara. Al pasar un rato, si se toca la cuchara que se encuentra en su interior, se nota que se va calentando cada vez más. Esta transferencia de calor se ha producido desde una sustancia, que es la leche, hasta un cuerpo, que es la cuchara.
2.-Convección
La propagación del calor por convección se da en los líquidos y en los gases. Es decir cuando calentamos un líquido o un gas en un recipiente, las primeras partículas en calentarse son las del fondo, por la que parte del líquido o del gas del fondo se dilata y disminuye su densidad y al ocurrir esto esta parte del líquido o gas asciende por el recipiente y la parte del líquido o gas que estaba encima baja para ocupar el espacio dejado, originándose las llamadas corrientes de convección que van calentando todas las sustancias del recipiente.
Ejemplos :
- El aire por convección origina los vientos.
- Si se coloca una espiral de cartulina, en un soporte universal y se sopla desde abajo hacia arriba se puede apreciar cómo esta comienza a girar alrededor del punto donde se apoya. También si se coloca una vela encendida o cualquier otra fuente de calor debajo del espiral, esta gira porque el aire que se calienta, asciende y esto se demuestra porque se pone en movimiento la espiral, igual que cuando se soplaba desde abajo hacia arriba. Por tanto, se producen corrientes de aire caliente que suben y de aire frío que baja.
3.-Radiación
La radiación es la propagación del calor que tiene lugar sin el apoyo del ningún medio material.
Ejemplos:
- Los radiadores
- Las aguas del mar reciben la radiación del sol por eso logran evaporarse.
- Los panaderos, cuando van a sacar el pan del horno, están recibiendo el calor procedente de este, por radiación.
- Los obreros metalúrgicos reciben mucho calor procedente de los altos hornos en que se funden los metales y ese calor les llega por radiación.
- En sus hogares, cuando mamá está cocinando, recibe por radiación el calor procedente de la cocina, puesto que no está situada encima de la fuente de calor, ni en contacto directo con ella, sino delante de las hornillas.
ejercicio
Los muros de un refugio de alta montaña
constan, desde el exterior, de una pared de hormigón de 15 cm de espesor, de
una capa aislante de 3 cm de espesor y de un recubrimiento interior de madera
de 1 cm de espesor.
a)
Calcula el flujo calorífico
conducido por m2 y hora a través de los muros cuando la temperatura
exterior es de –15ºC y la interior de 10ºC. (considera muy pequeña la resistencia térmica del muro a
radiación-convección).
b)
Obtén emperaturas en las
interfases del muro en la situación de equilibrio.
( /
/ /
/ , kcal. m-1.s-1.ºC-1)
, kcal. m-1.s-1.ºC-1)
http://www.educaycrea.com/2014/04/propagacion-del-calor-formas-y-ejemplos/
equivalencia mecánica del calor
Históricamente se tardó bastante tiempo en comprender cuál es la naturaleza del calor. En un primer momento se pensaba que el calor era un fluido (denominado calórico) que impregnaba los cuerpos y era responsable del calor que éstos intercambiaban al ser puestos en contacto.
En el siglo XIX, Joule ideó un experimento para demostrar que el calor no era más que una forma de energía, y que se podía obtener a partir de la energía mecánica. Dicho experimento se conoce como experimento de Joule para determinar elequivalente mecánico del calor.
Antes del experimento de Joule se pensaba que calor y energía eran dos magnitudes diferentes, por lo que las unidades en que se medían ambas eran también distintas. La unidad de calor que se empleaba era la caloría.
Una caloría es la cantidad de calor necesaria para elevar la temperatura de un gramo de agua destilada desde 14.5ºC a 15.5ºC..
|
Con su experimento, Joule se propuso demostrar que se podía elevar la temperatura del agua transfiriéndole energía mecánica. El aparato que empleó se muestra en la siguiente figura. En el interior de un recipiente se introduce 1 kg de agua a 14.5 ºC.
 |
Al recipiente se le acoplan unas paletas conectadas mediante una cuerda con una masa que puede caer. Conforme la masa cae a velocidad constante, las paletas giran, por lo que se convierte la energía potencial gravitatoria de la masa en energía para hacer girar las paletas. Debido a este giro, el agua aumenta de temperatura (el giro de las paletas se transforma en calor).
Lo que encontró Joule fue que, para elevar la temperatura del kilogramo de agua hasta 15.5ºC (es decir, para conseguir una energía de 1000 calorías), la energía potencial de la masa debía disminuir en 4180 Julios. Por tanto, la equivalencia entre unidades de calor y energía es:

El descubrimiento de Joule llevó a la teoría de la conservación de la energía lo que a su vez condujo al desarrollo del primer principio de la Termodinámica.
ejemplos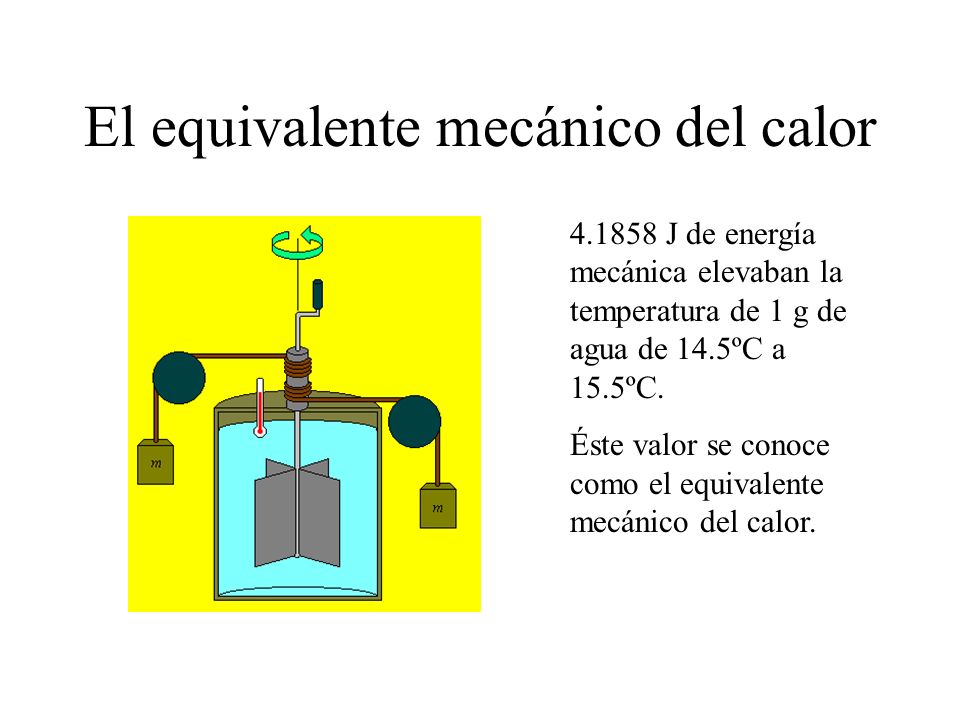 |

ejercicios
Problema n° 1) ¿Qué trabajo se podrá realizar mediante el calor producido por la combustión completa de 1000 kg de carbón que producen 9000 kcal, suponiendo que ha sido aprovechado totalmente?.
Desarrollo
Datos:
Q = 9000 kcal = 9000000 cal
1 cal
|
→
|
4,184 J
|
9000000 cal
|
→
|
E = 4,184 J.9000000 cal/1 cal
|
E = 37.656.000 J
Problema n° 2) ¿Qué cantidad de calor será necesaria para producir un trabajo ideal de 0,25 kW.h?.
Desarrollo
Datos:
L = 0,25 kW.h = 250 W.h
1 W.h
|
→
|
3600 J
|
250 W.h
|
→
|
E = 3600 J.250 W.h/1 W.h
|
E = 900000 J
1 J
|
→
|
0,239 cal
|
900000 J
|
→
|
E = 0,239 cal.900000 J/1 J
|
E = 215105 cal
¿Qué cantidad de calor será necesario para realizar un trabajo de 8 kW.h?
Desarrollo
Datos:
E = 8 kW.h = 8000 W.h
1.W.h
|
→
|
3600 J
|
8000 W.h
|
→
|
x = (8000 W.h).(3600 J)/(1 W.h)
|
E = 28800000 J
1 J
|
→
|
0,239 cal
|
28800000 J
|
→
|
E = 0,239 cal.28800000 J/1 J
|
http://www.fisicanet.com.ar/fisica/termodinamica/resueltos/tp06_equivalente_mecanico_problema06.php
http://acer.forestales.upm.es/basicas/udfisica/asignaturas/fisica/termo1p/joule.html
primera ley de termodinámica

La primera ley de la termodinámica establece que la energía no se crea, ni se destruye, sino que se conserva. Entonces esta ley expresa que, cuando un sistema es sometido a unciclo termodinámico, el calor cedido por el sistema será igual al trabajo recibido por el mismo, y viceversa.
Es decir Q = W, en que Q es el calor suministrado por el sistema al medio ambiente y W el trabajo realizado por el medio ambiente al sistema durante el ciclo.
Un ejemplo sencillo seria: Al remover con un taladro el agua contenida en un recipiente, le estamos aplicando trabajo, que es igual al calor que este emite al medio ambiente al calentarse. En este caso, el sistema puede ser el agua, el medio sería el taladro, el aire circundante y todo lo que está fuera del sistema que no sea agua (pues lo que está afuera recibirá calor del sistema).
ejemplos


ejercicios
Se sitúan 15 L de gas ideal en un recipiente a 27 ºC. El recipiente cuenta con un pistón móvil libre de rozamiento. La presión en el exterior se mantiene constante a 750 mmHg. Determina, si se eleva la temperatura a 190 ºC:
- El trabajo realizado en el proceso
- La variación de energía interna que tiene lugar
- El calor transferido durante el mismo
- Representa el proceso en un diagrama presión - volumen ( p - V )
Datos : cv = 5·R/2 ; R = 8.31 J/ mol·K
- Usaremos el criterio de signos tradicional según el cual el trabajo es positivo se realiza contra el exterior

Resolución
1.
En los procesos a presión constante el trabajo termodinámico, según el criterio de signos establecido, viene dado por la expresión:
Para determinar el volumen final podemos aplicar la ecuación de estado de los gases ideales, de la siguiente manera:
La expresión anterior constituye la ley de Charles y Gay-Lussac. A partir de ella, nos queda:
Y volviendo a la expresión del trabajo termodinámico nos queda:
http://www.fisicalab.com/ejercicio/1562/avanzado
http://curiosidades.batanga.com/4383/la-primera-ley-de-la-termodinamica
maquinas térmicas de vapor
Denominamos máquinas térmicas a aquellas que transforman la energía calorífica de los combustibles (carbón, madera, gasolina, gasóleo, etc) en energía mecánica, en movimiento.
Lás máquinas térmicas, según la forma de realizar la combustión, pueden ser de dos tipos:
- De combustión externa, emplean combustibles fósiles como el carbón el ejemplo por excenlencia es la máquina de vapor, en la que la combustión sucede fuera de la máquina para calentar un fluido, como el agua que, en forma de vapor, moverá algún mecanismo.
- De combustión interna, emplean combustibles fósiles, como el petróleo, que producen el movimiento al arder en una cámara dentro del propio motor. Existen motores de combustión interna sencillos, ligeros y de poca potencia, como los de las motocicletas, y otros que desarrollan gran potencia , como las turbinas de gas de los aviones.
Máquina de vapor de James Watt

Animación de la máquina de vapor
http://html.rincondelvago.com/maquinas-termicas-y-la-segunda-ley-de-la-termodinamica.html
segunda ley de termodinámica
| La segunda ley de la termodinámica es un principio general que impone restricciones a la dirección de la transferencia de calor, y a la eficiencia posible en los motores térmicos. De este modo, va más allá de las limitaciones impuestas por la primera ley de la termodinámica. Sus implicaciones se pueden visualizar en términos de la analogía con la cascada |
|

La máxima eficiencia que se puede conseguir es la eficiencia de Carnot.
ejemplos
1. Una pelota que rebota en el piso
energía disipada
dirección de cambio espontaneo
Ec −→ Q
Reacción química
H2
+ → H2O
O2
Reacción espontánea
a condiciones normales
ejercicios
El refrigerante
134ª entra como mezcla saturada de liquido
vapor a una presión de 160 kPa en el serpentín de un evaporador de un sistema
de refrigeración. El refrigerante absorbe 180 kJ de calor del espacio
refrigerado que se mantiene – 5 oC y sale como vapor saturado a la misma presión. Determinar a)
cambio de entropía del refrigerante, b) Cambio de entropía del espacio
refrigerado, c) Cambio de entropía total.
Respuesta.
En la zona de
mezcla saturada la presión y la
temperatura son constantes, por lo tanto la temperatura del refrigerante sea la
temperatura de saturación a la presión dada de 160 kPa, por lo que Ts = - 15,62 oC.
a) Cambio de
entropía del refrigerante:

b) Cambio de
entropía del espacio refrigerado:

El Qer
es negativo ya que el espacio refrigerado cede calor.
c) Cambio de
entropía total:
ΔStotal = ΔSistema
+ ΔSalrrededores = ΔSref + ΔSer = (0,699 –
0,672)kJ/K = 0,027 kJ/k por el resultado obtenido el proceso es posible e
irreversible., ya que Sgenerada
= 0,027 kJ/k.
http://depa.fquim.unam.mx/jesusht/segundaley.pdf






No hay comentarios.:
Publicar un comentario